实验原理
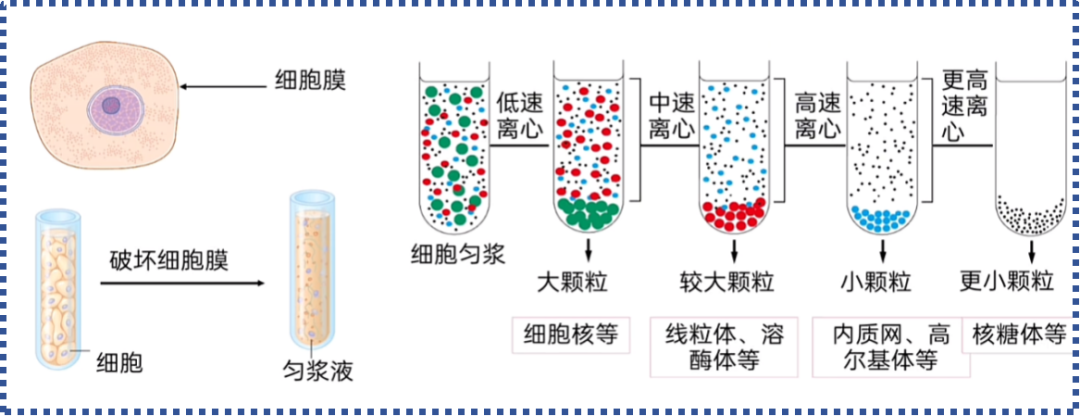
利用低浓度去垢剂选择性裂解细胞膜,同时保持核膜完整,然后通过差速离心进行分离。
1.选择性裂解:
使用含有低浓度非离子去垢剂的等渗缓冲液。这种浓度足以溶解细胞膜和胞浆膜结构,但无法破坏结构更坚固的核膜。
2.差速离心:
通过控制离心力,可以初步将细胞核(沉淀)与胞浆成分(上清)分离开。
1)低速离心:完整的细胞核是细胞中最大最重的细胞器,在较低转速下(500-1,000g)即可沉淀。
2)高速离心:胞浆蛋白、细胞器(线粒体、微粒体等)需要更高的转速(10,000g以上)才能沉淀。
操作步骤
第一步:细胞收集与洗涤:
1)吸弃培养皿中的培养基;
2)用预冷的PBS轻柔地洗涤细胞2次,彻底洗去残留的血清(血清中含蛋白酶);
3)彻底吸尽PBS。
Tip:使用胰酶处理贴壁细胞时要严格注意消化时间;胰酶会使细胞变得很脆弱,影响后续核质分离;不同细胞种类其核质分离结果略有所不同。
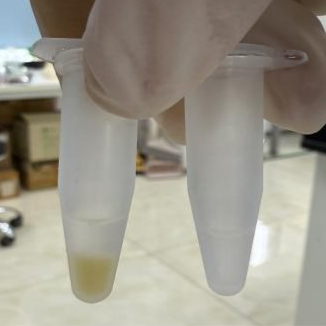
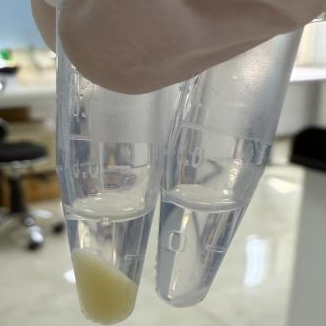
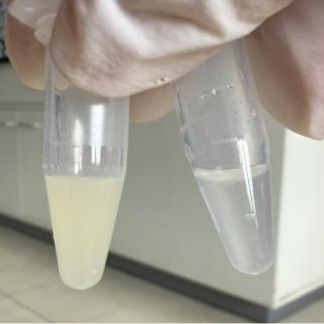
图片中左侧为细胞数量是2×106个数的CHO-S细胞(黄色细胞沉淀);图片右侧为细胞数量1×105个数的Raw(白色细胞沉淀),作为反面对照,细胞个头较小,数量太少,对后续提出的蛋白浓度以及核浆分离结果有较大的影响。
第二步:细胞裂解:
1)加入一定量的裂解液裂解细胞;
2)涡旋振荡10-15秒(或剧烈吹打),以充分裂解细胞。此时应观察到液体变得非常粘稠(因DNA释放);
3)冰上孵育10-15分钟。此时,细胞会因裂解而变得粘稠,透亮。
Tip:2×106个细胞体积通常为20μL,需要使用细胞计数仪检测密度后,再取2×106个细胞进行后续实验。
第三步:离心分离:
1)在4°C, 1000g离心5-10分钟;
2)离心后,溶液分为两层:
A.上面一层是上清(Supernatant):即为胞浆蛋白提取物;小心将其转移到一个新的预冷离心管中,二次离心,确保细胞浆蛋白的干净无污染。
B.下面的沉淀(Pellet):包含完整的细胞核以及未破碎的完整细胞、细胞骨架等,等待后续细胞核蛋白的裂解。


第四步:洗涤细胞核(关键纯化步骤):
1)向沉淀中加入适量预冷的细胞浆裂解缓冲液;用移液器非常轻柔地重悬沉淀;
2)再次在4°C,1000 g离心5分钟;
3)小心吸弃上清;此时得到的沉淀是较纯的细胞核。
Tip:吸头切勿触及细胞沉淀,为降低胞浆组分对细胞核组分的污染,可以在沉淀上方保留极小体积的上清,换用10 μL的吸头尽可能吸尽,必要时可将极小体积上清弃掉。

第五步:核蛋白提取
1)向洗净的细胞核沉淀中加入适量的预冷细胞核裂解缓冲液;
2)在4°C下,通过涡旋或轻柔吹打重悬沉淀,并在摇床上孵育40分钟,使核膜裂解,核蛋白充分释放;
3)在4°C 13000g 离心10分钟。小心吸取上清,即为核蛋白提取物;将胞浆蛋白和核蛋白分装后,于-80°C保存。
Tip:为保证提取的核蛋白干净无污染,吸取时,可以在沉淀上方弃掉小部分上清。

提取蛋白时,出现的相关问题
1、核质分离不彻底,出现交叉污染:

2、核蛋白提取效率低:
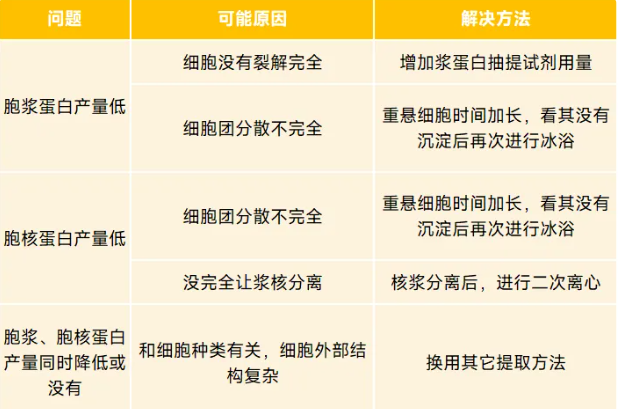
3、其他问题:

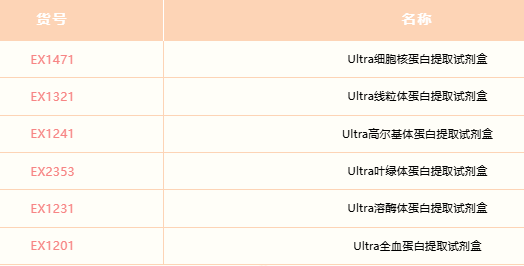
Solarbio Ultra系列蛋白提取试剂盒
相关产品